Auswahl einer passenden HPLC-Säule
Es gibt zehntausende unterschiedliche HPLC-Säulen. So finden Sie alleine im HPLC-Säulenkonfigurator mehr als 140.000 Säulen und Vorsäulen verschiedener Hersteller in allen möglichen Dimensionen. Aber wie findet man die passende Säule für seine Trennung? Die folgenden Selektionskriterien helfen dabei:
1. Hardware der Säule:
Die meisten HPLC-Säulen bestehen aus Stahl 316. Er ist bei den in der HPLC üblichen Drucken beständig und auch relativ inert gegen chemische Korrosion. Es ist sehr wichtig, dass die Innenseite einer Trennsäule keine Rauigkeiten, Riefen oder mikroporöse Strukturen aufweist (Meyer 2009, Seite 110).
2. Basismaterial
2.1 Silicagel:
Silicagel besteht aus Siliziumatomen, welche durch Sauerstoffatome dreidimensional verbrückt sind (Meyer 2009, S. 119). Hohe pH-Werte führen zur Auflösung des Silica-Gerüstes. Die chemische Stabilität ist ebenso höher bei hochreinen Silicagelen mit niedrigem Metallgehalt (Meyer 2009, S. 125). Silicagel trägt oberflächlich OH-Gruppen (Silanolgruppen). An diesen Stellen lässt sich das Silikagel chemisch verändern, so erhält man stationäre Phasen mit spezifischen Eigenschaften (Meyer 2009, S. 121). Neben der mechanischen Stabilität, besitzt Kieselgel vor allem den Vorteil einer kostengünstigen und einfachen Synthese und einer einfachen, preiswerten und flexiblen Möglichkeit der Oberflächenmodifizierung. Bei Kieselgel besteht die Möglichkeit die Porengröße eng verteilt einzustellen (Kromidas 2014, S. 246).
2.2 Polymersäulen:
Neben den silica-basierten Materialien sind für die RP-HPLC auch HPLC-Säulen auf Polymer-Basis erhältlich. Diese bestehen z.B. aus Polystyrol-Divinylbenzol und weisen eine höhere pH-Stabilität auf (pH 1-13). Damit stellen sie eine interessante Alternative für die Analytik im stark Sauren bzw. Basischen dar (HPLC-Säule 2016). Styrol-Divinylbenzol ist außerdem eine wichtige stationäre Phase für die Gelpermeations-Chromatographie (Meyer 2009, S. 126).
3. Form des Säulenmaterials
3.1 Poröse Partikel:
Neben den traditionellen vollporösen Phasen gibt es heutzutage auch Coreshell-Phasen, monolithische Phasen und Phasen für UHPLC mit kleinen Partikelgrößen. Poröse Partikel ist der übliche Typ von stationären Phasen für die HPLC. Die Korngröße der Partikel beträgt meist 3, 5 oder selten auch 10 µm. Die innere Struktur ist vollkommen porös und kann am besten mit einem Schwamm verglichen werden (Meyer 2009, S. 116).
3.2 Coreshell-Partikel:
Core-Shell Partikel haben einen festen Kern und nur die äußere Hülle ist porös. Dieser feste Kern führt zu einer erhöhten Trennleistung. Die Partikel haben eine einheitlichere Partikelgrössenverteilung und lassen sich dadurch besser packen, der A-Term der Van-Deemter-Gleichung wird erniedrigt. Zusätzlich ist der Stoffaustausch der Moleküle in die Poren (C-Term der Van-Deemter Gleichung) beschleunigt. Ein Nachteil der Coreshell-Partikel ist die geringere Beladbarkeit.
3.3 Monolithische Phasen:
Eine monolithische Phase besteht aus einem einzigen Stück porösen Materials, wie Silicagel oder organischem Polymer. Das chromatographische Bett besteht nicht aus Partikeln, sondern aus einem porösen Stab, welches das Innenvolumen der Säule vollständig ausfüllt. Die Trennleistung von Monolithen ist mit gepackten 3 µm Phasen vergleichbar. (Meyer 2009, S.118). Bei monolithischen Phasen ist die Verfügbarkeit an Selektivitäten gegenüber total porösen Materialien eingeschränkt (Kromidas 2014, S. 152).
4. Gebundene Phase
Die Vielfalt an verfügbaren stationären Phasen (Reversed Phase, Normal Phase, Phenylphasen….) diverser Hersteller trägt dazu bei, dass es nicht immer ganz einfach ist, schnell die passende HPLC Säule zu finden.
Für ca. 80-90 % aller Analysen kann eine gängige Reversed Phase C18 Säule eingesetzt werden. Erste Maßnahme bei dieser Entscheidung ist die Betrachtung des zu untersuchenden Moleküls. Handelt es sich um ein sehr polares Molekül dann besteht die Möglichkeit dass es nicht von einer C18 Säule retardiert werden kann und in der Totzeit eluiert. In diesem Fall muss man dann eher auf eine C4, CN, Diol oder Phenylphase zurückgreifen. Ebenso gibt es das andere Extrem dass die Probe eventuell zu unpolar ist und nicht mehr von der C18 Phase eluiert werden kann und irreversibel anhaftet. Passende Alternative wäre dann eine Silica, CN oder NH2 Phase (Kromidas, 1997 S. 32-33). Dies ist meist der Fall, wenn die Probe nur in Heptan oder Hexan löslich ist.
Ist die Entscheidung für die Phase getroffen ist die erste Hürde genommen. Nun wird es jedoch noch komplizierter, da man sich zwischen verschiedenen Dimensionen und Spezifikationen für die zukünftige Säule wie Partikelgröße, Porengröße, Innendurchmesser, Durchmesser und Kohlenstoffgehalt entscheiden muss.
Tabelle 1: Übersicht gebundene Phasen ((HPLC-Säule 2016)
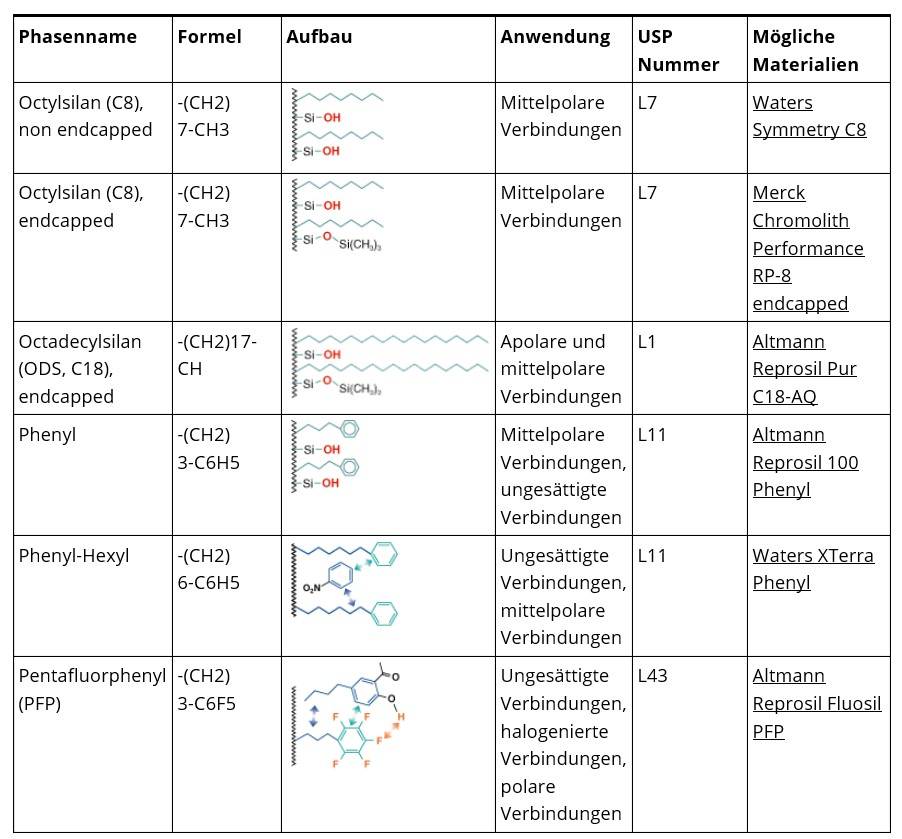
5. Partikelgröße:
Kleinere Partikelgrößen ergeben eine bessere Auflösung als größere Partikel. Größere Partikel erzeugen jedoch hingegen einen geringeren Rückdruck.
Neben der Größe des Partikels ist eine einheitliche Partikelgrößenverteilung besonders wichtig. Ein erhöhter Anteil an kleinen Partikeln erhöht den Gegendruck, bei mehr größeren Partikeln verliert das Material an Bodenzahl. Ein zusätzliches Problem einer breiten Partikelgrößenverteilung ist die schlechtere Packbarkeit des Materials (Kromidas 2014, S. 290). Die Größe des Teilchens hat Einfluss auf die Güte der Auflösung, da die Größe der Teilchen den A und den C-Term der Van-Deemter Gleichung beeinflusst.
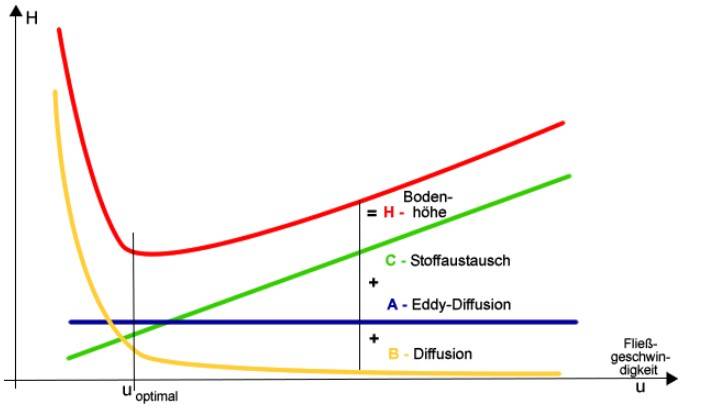
Abbildung 1: Terme der Van-Deemter-Gleichung (ChemgaPedia 2016)
Optimale Trennleistung erhält man bei dem Minimum an Bodenhöhe, dadurch wird die Gesamtzahl der Trennböden in der Säule erhöht. Vor allem wenn der A und C-Term minimiert werden kann, besteht die Möglichkeit über einen großen Flussbereich eine gute Trennleistung zu erreichen.
6. Porengröße:
Die Faustregel lautet: Je größer das zu analysierende Molekül ist, desto größer muss auch die Porengröße gewählt werden. Die Porengröße wird meist in Å angegeben, 10 Å =1nm. Für kleinere Moleküle ist eine Säule bis zu 120 Å passend für große Biomoleküle sollte man eher auf eine Porengröße von 300 Å zurückgreifen(Kromidas 2014)(Kromidas 2014). Biomoleküle gibt es in einem breiten Größenbereich, daher ist dort die Auswahl der richtigen Porengröße von entscheidender Bedeutung. Phasen mit kleineren Poren haben mehr Oberfläche, mehr Wechselwirkungsmöglichkeiten und können höher beladen werden (Kromidas 2014, S. 291).
Tabelle 2: Säulenauswahltool (YMC 2015)
|
MW |
Å |
C18 |
C8 |
C4 |
|
|
120 |
+++ |
++ |
+ |
|
> 5000 |
200 |
++ |
+++ |
++ |
|
>20000 |
300 |
+ |
++ |
+++ |
7. Innendurchmesser/Länge
Die Wahl der Dimensionen der HPLC-Säule hängt von der Analyse ab und davon wieviel Substanz getrennt werden soll. Ebenso limitiert die zur Verfügung stehende Anlage die Dimensionen (Moldoveanu & David 2013, S. 227).
Tabelle 3: Klassifikation HPLC Säulen nach Dimension (Moldoveanu & David 2013)
|
|
Innendurch-messer (mm) |
Länge (mm) |
Flußrate (ml/min) |
Probenmenge (µg) |
|
Präparativ |
>25 |
300 oder größer |
>20 |
>25000 |
|
Semi-Präparativ |
10 |
250 oder größer |
5-10 |
10000-20000 |
|
Analytisch Konventionell |
3;4; 4.6 |
50;100; 150; 250 |
0.5-2 |
50-200 |
|
Analytisch Narrowbore |
2;2.1 |
50;100; 150; 250 |
0.2-0.5 |
20-100 |
8. Leitfaden Säulenauswahl
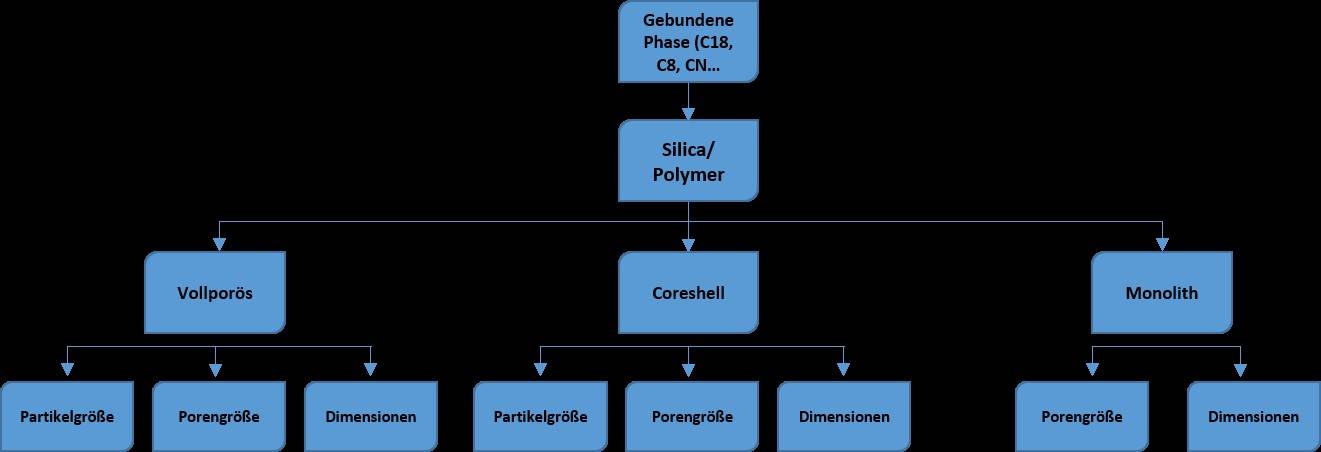
Abbildung 2: Säulenauswahl
Literaturverzeichnis:
ChemgaPedia, 2016. Van Deemter. http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/croma/chromatographie_grundlagen.vlu/Page/vsc/de/ch/3/anc/croma/basics/saulen_chr/deemter/van_deemterm57ht0500.vscml.html [Zugriff 18.01.2024 via archive.org].
HPLC-Säule, 2016. HPLC. Available at: http://hplc-saeule.de/rp-hplc-mit-gebundenen-phasen/.
Kromidas, S., 2014. Der HPLC Experte, Weinheim: Wiley-VDH Verlag GmbH & Co. KGaA.
Kromidas, S., 1997. HPLC-Tipps, Saarbrücken: Hoppenstedt Publishing GmbH, Darmstadt.
Meyer, V.R., 2009. Praxis der Hochleistungsflüssigkeitschromatographie 10th ed., Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA.
Moldoveanu, S.C. & David, V., 2013. Essentials in Modern HPLC Separations 1st ed., Elsevier.
YMC, 2015. YMC America. http://www.ymcamerica.com/capillary-lc/capillary-lc-bioseparations.htm [Zugriff 18.01.2024 via archive.org].